CeraOss™ HYA - bovines Knochenersatzmaterial mit Hyaluronsäure

CeraOss™ HYA ist ein Knochenersatzmaterial, welches die Vorteile von volumenstabilem, natürlichem Rinderknochen (CeraOss™) mit den positiven Eigenschaften von Hyaluronsäure, sowohl auf das Handling als auch auf die Defektregeneration, miteinander vereint. Während die Knochenpartikel ein osteokonduktives Gerüst bieten und eine dauerhafte Volumenstabilität gewährleisten, bildet Natriumhyaluronat in Kontakt mit wässrigen Lösungen eine viskose Konsistenz aus, welche dazu führt, dass die Partikel nach Hydrierung in einer zusammenhängenden, formbaren Masse gebunden werden. Dadurch wird die Handhabung verbessert und die Applikation des Materials an den Knochendefekt erleichtert. CeraOss HYA bietet daher eine ideale Synergie zwischen Benutzerfreundlichkeit und langfristiger Volumenstabilität.
Produktmerkmale*
- Vereinfachte Handhabung
Nach der Hydrierung mit Kochsalzlösung oder Blut bildet CeraOss HYA ein formbares Knochenersatzmaterial, das sowohl die Aufnahme als auch den Transfer in den Defektbereich erleichtert und so den chirurgischen Eingriff beschleunigt.1, 2
- Vergleichbar mit der Struktur des menschlichen Knochens
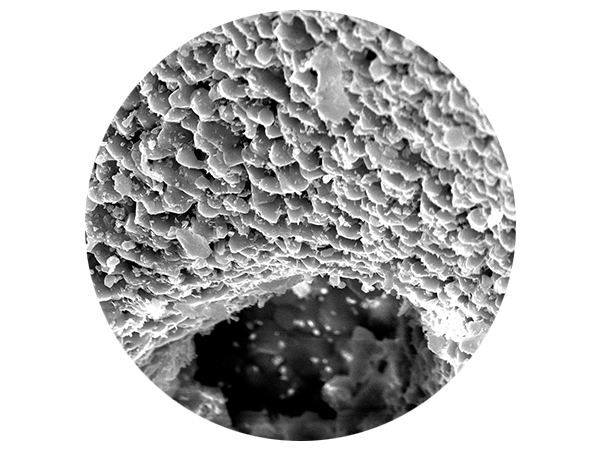
Die bovinen Granula haben eine Porosität von ~65–80 % mit einem dreidimensionalen Netzwerk von Makroporen (fördern das Einwachsen von Blutgefäßen und knochenbildenden Zellen) und Mikroporen (schnelle Blutaufnahme durch Kapillareffekt). Darüber hinaus erleichtert die raue Oberfläche die Adhäsion von Osteoblasten und Signalmolekülen und trägt zur knöchernen Integration des Granulates bei.3, 4
- Verbesserte Angiogenese
Der Chorioallantoismembran-Test zeigte, dass Natriumhyaluronat die Vaskularisation von Knochenaugmentaten in-vivo fördert.5
- Erhöhte Zellaktivität
Menschliche Osteoblasten zeigten eine verbesserte Lebensfähigkeit, Proliferation und Migrationsaktivität bei CeraOss HYA auf im Vergleich zu einem Knochenersatzmaterial ohne Hyaluronat in-vitro.6
- Unterstützt die Knochenregeneration
Hyaluronsäure unterstützt die Bildung von mineralisierter und nicht mineralisierter Knochenmatrix.
- Dauerhafte Volumenstabilität
Die Granula in CeraOss HYA zeigen nur eine oberflächliche Resorption und bieten somit eine dauerhafte, strukturelle Unterstützung, die besonders im ästhetischen Bereich oder zur Erhaltung der Kieferkontur wichtig ist.8, 9 Darüber hinaus kann durch die Mischung von CeraOss HYA mit Auto- oder Allografts ein volumenstabiles Augmentat mit beschleunigter Regeneration hergestellt werden.11
- Sicher
Potenzielle infektiöse Erreger wie Bakterien, Viren und Prionen werden durch die Hochtemperaturbehandlung (>1200 °C) aus dem Rinderknochen eliminiert.12
Natriumhyaluronat wird biotechnologisch mittels Fermentation hergestellt (nicht tierisch), wodurch unerwünschte Reaktionen gegen tierische Materialien ausgeschlossen werden. Biokompatibilitäts- und Immunogenitäts-Analysen in-vivo zeigten, dass die Gewebe- und Immunreaktionen auf CeraOss HYA vergleichbar mit der Kontrollgruppe (KEM ohne zugesetztes Hyaluronat) waren.13
- Natürlich resorbierbares Biopolymer
Histologische Untersuchungen bestätigten, dass Natriumhyaluronat innerhalb von zwei Wochen natürlich durch enzymatischen Abbau resorbiert wird.13
- Effizient in der Periimplantitis-Therapie
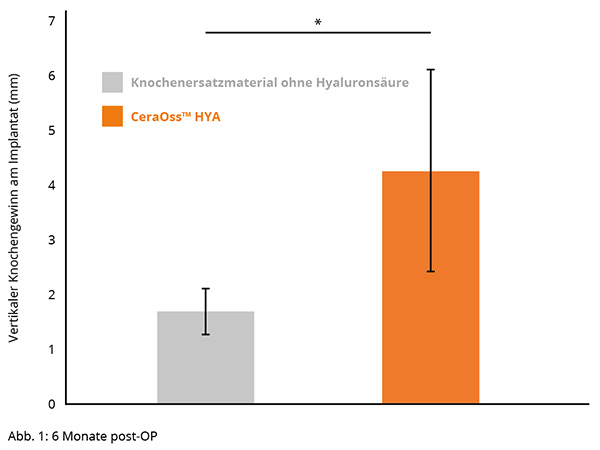
Eine randomisierte kontrollierte klinische Studie zeigte einen statistisch signifikanten vertikalen Knochenzuwachs auf der mesialen, distalen und oralen Implantatseite, wenn die periimplantären Knochendefekte mit hyaluronhaltigem KEM (CeraOss HYA) augmentiert wurden. Darüber hinaus wurde eine verbesserte Implantatstabilität via erhöhter ISQ-Werte 3 und 6 Monate postoperativ beobachtet.14
* Studien wurden unter Verwendung von cerabone® und cerabone® plus durchgeführt, botiss Knochenersatzmaterialien, die identisch mit CeraOss bzw. CeraOss HYA sind.
CeraOss HYA – Vorteile bei der Regeneration
- Regt die Bildung von Blutgefäßen in-vivo5 an und verbessert die biologische Aktivität von Osteoblasten in-vitro.6, 7
- Verbessert die Knochenregeneration14
- Erhöht die Implantatstabilität14
Randomisierte kontrollierte klinische Studie zur rekonstruktiven Chirurgie bei Periimplantitis
Patienten, die mit CeraOss HYA behandelt wurden, zeigten im Vergleich zu solchen, die mit CeraOss behandelt wurden, eine statistisch signifikant höhere marginale Knochendicke in vertikaler Dimension an mesialen, distalen und oralen Implantatstellen, 6 Monate postoperativ (*p < 0.05) (Abb. 1).14
Außergewöhnliche Flüssigkeitsbindung
Natriumhyaluronat ist die konjugierte Base der Hyaluronsäure, ein anionisches, nicht sulfatiertes Glykosaminoglykan, das weit verbreitet in Bindegewebe und epithelialem Gewebe vorkommt. Hyaluronsäure ist eines der hygroskopischsten Moleküle in der Natur und kann das Tausendfache seines Gewichts an Wasser absorbieren. Nach der Hydratation entstehen Wasserstoffbrückenbindungen zwischen den Wassermolekülen und den benachbarten Carboxyl- und N-Acetylgruppen der Hyaluronsäure. Auf diese Weise bindet die Hyaluronsäure die Flüssigkeit und bildet eine viskose Lösung, die das Granulat zusammenhält und eine präzise Partikelapplikation ermöglicht. In der Formulierung von CeraOss HYA fungiert Natriumhyaluronat daher als Trägersubstanz für die bovinen Knochengranulate.
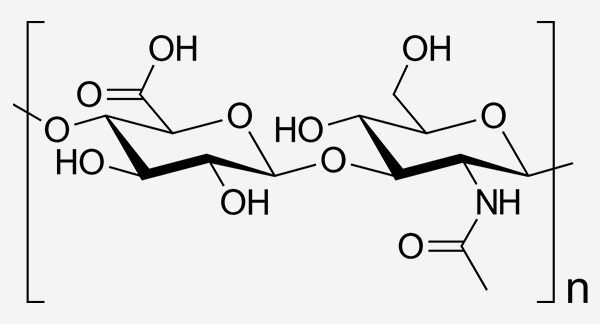
Strukturformel der Hyaluronsäure
Hyaluronsäure ist ein Biopolymer, das aus sich wiederholenden Einheiten von d-Glucuronsäure und N-Acetyl-d-Glucosamin besteht. Das Molekulargewicht des Polymers wird durch den Polymerisationsgrad (n) bestimmt. Hochmolekulares Hyaluronat weist eine längere Abbauzeit auf und wirkt entzündungshemmend.15
Bakteriostatische Effekte
Die Anwendung von Hyaluronsäure in Form von Membranen, Gelen und Schwämmen zeigte bakteriostatische Effekte bei chirurgischen Wunden und reduziert das Risiko postoperativer Infektionen, wodurch die Vorhersagbarkeit der Defektregeneration gefördert wird.16
Hyaluronsäure in der Zahnmedizin
Hyaluronsäure ist ein wesentlicher Bestandteil der Matrix des parodontalen Ligaments und beeinflusst die Zelladhäsion, Migration und Differenzierung über die Bindungsproteine und Zelloberflächenrezeptoren. Die Vorteile von Hyaluronsäure für den Heilungsprozess von parodontalen Wunden, einschließlich Entzündung, Granulationgewebebildung, Epithelbildung und Geweberemodellierung sind ausführlich in der Literatur beschrieben.17–22 Es wurde auch gezeigt, dass Hyaluronsäure eine frühere Ablagerung von trabekulärem Knochen in Zahnfächern induzierte und die Expression osteogener Proteine wie Knochenmorphogenetisches Protein-2 (BMP-2) und Osteopontin stimulierte. 23
1 Cerabone® plus usability test.
2 78.5% of users reported easier or much easier application compared to particulate material without hyaluronic acid; Data on file: Customer survey among 156 clinicians.
3 Tadic et al. Comparison of different methods for the preparation of porous bone substitution materials and structural investigations by synchrotron μ-computer tomography. Mat.-wiss. u. Werkstofftech. 2004, 35, No. 4.
4 Seidel and Dingeldein 2004. cerabone® – Bovine Based Spongiosa Ceramic Seidel et al. Mat.-wiss. u. Werkstofftech. 35:208–212.
5 Kyyak et al. Hyaluronic Acid with Bone Substitutes Enhance Angiogenesis In Vivo. Materials (Basel) 2022. 15(11):3839.
6 Kyyak et al. The Influence of Hyaluronic Acid Biofunctionalization of a Bovine Bone Substitute on Osteoblast Activity In Vitro. Materials (Basel). 2021. 14(11):2885.
7 Qasim SSB, Trajkovski B, Zafiropoulos GG. The response of human osteoblasts on bovine xenografts with and without hyaluronate used in bone augmentation. J Biomater Sci Polym Ed. 2024 Apr;35(6):880- 897. doi: 10.1080/09205063.2024.2311454. Epub 2024 Feb 12. PMID: 38346177.
8 Zhao, N., Wang, X., Qin, L., Zhai, M., Yuan, J., Chen, J., & Li, D. (2016). Effect of hyaluronic acid in bone formation and its applications in dentistry. Journal of biomedical materials research Part A, 104(6), 1560-1569.
9 Tawil et al. 2018. Sinus Floor Elevation Using the Lateral Approach and Window Repositioning and a Xenogeneic Bone Substitute as a Grafting Material: A Histologic, Histomorphometric, and Radiographic Analysis. Int J Oral Maxillofac Implants.33(5):1089-1096.
10 Riachi et al. 2012. Influence of material properties on rate of resorption of two bone graft materials after sinus lift using radiographic assessment. Int J Dent. 2012:737262.
11 Kloss et al. First Clinical Case Report of a Xenograft-Allograft Combination for Alveolar Ridge Augmentation Using a Bovine Bone Substitute Material with Hyaluronate (Cerabone® Plus) Combined with Allogeneic Bone Granules (Maxgraft®). J Clin Med. 2023. 12(19):6214.
12 Brown et al. New studies on the heat resistance of hamster-adapted scrapie agent: threshold survival after ashing at 600 degrees C suggests an inorganic template of replication, PNAS 2000. 97(7): 3418–3421.
13 Pröhl A et al. In Vivo Analysis of the Biocompatibility and Bone Healing Capacity of a Novel Bone Grafting Material Combined with Hyaluronic Acid. Int J Mol Sci. 2021. 22(9):48
14 Rakašević et al. Reconstructive Peri-Implantitis Therapy by Using Bovine Bone Substitute with or without Hyaluronic Acid: A Randomized Clinical Controlled Pilot Study. J Funct Biomater. 2023 Mar 8;14(3):149.
15 Rayahin, J. E., Buhrman, J. S., Zhang, Y., Koh, T. J., & Gemeinhart, R. A. (2015). High and low molecular weight hyaluronic acid differentially influence macrophage activation. ACS biomaterials science & engineering, 1(7), 481-493.
16 Pirnazar P. et al. ’Bacteriostatic effects of hyaluronic acid. Journal of Periodontology 1999. 70:370-374.
17 Håkansson et al. Regulation of granulocyte function by hyaluronic acid. In vitro and in vivo effects on phagocytosis, locomotion, and metabolism. J Clin Invest. 198066:298–305.
18 Wisniewski HG, Vilcek J. TSG-6: An IL-1/TNF-inducible protein with anti-inflammatory activity. Cytokine Growth Factor Rev. 1997. 8:143-56.
19 Larjava et al. Characterization of one phenotype of human periodontal granulation-tissue fibroblasts. J Dent Res. 1989. 68:20-25.
20 Bartold PM, Page RC. The effect of chronic inflammation on gingival connective tissue proteoglycans and hyaluronic acid. J Oral Pathol. 1986. 15:367-74.
21 Bertolami CN, Messadi DV. The role of proteoglycans in hard and soft tissue repair. Crit Rev Oral Biol Med. 1994. 5:311-37.
22 Ruggiero et al. Hyaluronidase activity of rabbit skin wound granulation tissue fibroblasts. J Dent Res. 1987. 66:1283-7.
23 Mendes et al. Sodium hyaluronate accelerates the healing process in tooth sockets of rats. Arch Oral Biol. 2008. 53:1155-62.
CeraOss™ – bovines Knochenersatzmaterial

CeraOss™ ist ein 100 % reines Knochenmineral bovinen Ursprungs, das bei 1200 °C durch ein spezielles Herstellungsverfahren gewonnen wird. Seine dreidimensionale poröse Struktur ermöglicht eine schnelle Penetration und Adsorption von Blut- und Serumproteinen und dient als Reservoir für Proteine und Wachstumsfaktoren. Das spezielle Herstellungsverfahren sorgt für maximale Sicherheit und führt zur ausserordentlich hohen Reinheit von CeraOss sowie zu höchster Volumenstabilität an der augmentierten Stelle.1-3
Anwendungen von CeraOss
- Augmentation/Rekonstruktion des Kieferkamms
- Auffüllen knöcherner Defekte (u. a. nach Wurzelresektion, Wurzelspitzenresektion oder Zystektomie)
- Auffüllen von Extraktionsalveolen zur Unterstützung des Alveolarkammerhalts
- Sinusbodenaugmentation (Sinuslift)
- Auffüllen parodontaler knöcherner Defekte
- Auffüllen von Extraktionsalveolen im Rahmen von Sofortimplantationen
- Auffüllen periimplantärer knöcherner Defekte